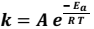Perito Criminal - Área Geral - 2021
Sob condições adequadas e na presença de oxigênio, a prata metálica pode ser oxidada, de acordo com a reação que segue:
4 Ag(s) + O2(g) + 4 H+ (aq) → 4 Ag+ (aq) + 2 H2O(l)
Com base nessa reação, o valor da variação de energia livre de Gibbs padrão (ΔG0) é, aproximadamente, igual a
Dados: E0 Ag+/Ag0 = −0,80 V; E0 O2(g)/H2O = 1,23 V; Constante de Faraday (F) = 96500 C mol-1
Uma solução aquosa contém íons Ag+ e íons Pb2+ nas concentrações de 1,0x10-2 mol/L e 2,0x10-2 mol/L, respectivamente. A essa solução é adicionado sal contendo íons cloreto (Cl-). Diante dessa condição, assinale a alternativa correta.
Dados: Kps AgCl = 1,8x10-10; Kps PbCl2 = 1,7x10- 5 ; √8,5 = 2,9
Considere uma mistura de 1,0 mol de benzeno (C6H6) e 2,0 mols de tolueno (C7H8), constituindo uma solução ideal. À 20 °C, a pressão de vapor (P0) das substâncias puras são P0benzeno = 75 torr e P0tolueno = 22 torr.
Diante do exposto, assinale a alternativa correta.
A reação entre o benzoato de etila e o hidróxido de sódio tem como produtos
O sulfeto de cobre é um dos compostos de cobre (II) menos solúveis (Kps = 6,3x10-36). Essa substância não se dissolve em NaOH, NH3 ou ácidos não-oxidantes, entretanto se dissolve em ácido nítrico para formar enxofre. Assinale a alternativa que apresenta corretamente e, devidamente balanceada, a reação entre o sulfeto de cobre (II) e ácido nítrico.
Para uma determinada análise forense, foi necessário preparar uma solução para estabilizar o pH em 5,0. Para isso, foi preparada uma mistura contendo 0,2 mol de ácido metanoico e uma quantidade de metanoato de sódio, perfazendo o volume total de 2 litros. A massa, em gramas, de metanoato de sódio necessária para obter essa solução é, aproximadamente, igual a
Foram dissolvidos 5,0 g de sulfato de cobre (II) penta-hidratado em água, sendo avolumado para um balão volumétrico de 500 mL. Uma alíquota de 10 µL dessa solução foi transferida para um frasco volumétrico de 25 mL sendo avolumada com água. A respeito desse procedimento, é correto afirmar que
Observação: considere a densidade da solução igual a 1,0 g/mL.
Assinale a alternativa que classifica corretamente os seguintes elementos, em ordem crescente de raio atômico: ferro, potássio, rubídio, enxofre e selênio.
Observação: utilize apenas a tabela periódica para a resolução.
A dependência da cinética química em relação à temperatura tem sido estudada extensivamente. Para diversas reações, uma relação empírica, chamada de equação de Arrhenius, pode ser usada para descrever a dependência da constante de velocidade (k) em relação à temperatura:
Nessa equação, Ea é a energia de ativação, R é a constante dos gases, T é a temperatura absoluta e A, o fator de frequência (considerado aproximadamente constante). Com base nessa relação empírica descrita, assinale a alternativa correta.
Assinale a alternativa na qual NÃO é possível atingir o seguinte equilíbrio:
CaCO3(s) ⇌ CaO(s) + CO2(g)
sabendo que cada uma das seguintes misturas (ou uma dada substância) está contida em um recipiente fechado sob determinada temperatura e em repouso.