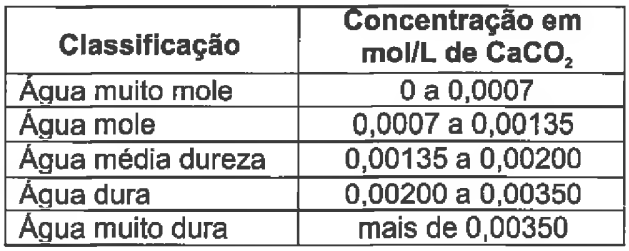
A dureza da água se define como a presença de íons di, tri e polivaientes, em especial, os íons Ca2+ e Mg2+. Um método que é comumente empregado para a deter...
2013
FUNCAB
A dureza da água se define como a presença de íons di, tri e polivaientes, em especial, os íons Ca2+ e Mg2+. Um método que é comumente empregado para a determinação da dureza é acidificar uma amostra de água com HCI, levar à ebulição a solução ácida para eliminar o CO2 e neutralizá-la com NaOH. À solução se acrescenta solução tampão amoniacal até pH~10 e a solução resultante é titulada contra EDTA, utilizando-se o Negro de Eriocromo T como indicador para visualização do ponto final da titulação. A estequiometria do quelato EDTA com o metal é 1:1. Se uma amostra de água de 50,00 mL requer 15,00 mL de solução de EDTA 0,010 mol/L para alcançar o ponto final, esta pode ser classificada, segundo a tabela abaixo, como: